Практически каждый из нас держал в руках гальванический элемент, называя его батарейкой. В этой статье мы поговорим об этом химическом источнике тока, изобретенном в далеком 18 веке, выясним, как он работает, и соберем простейшую «батарейку» своими руками.
Что это такое
Гальванический элемент (ГЭ) – это устройство, преобразующее химическую энергию в электрическую. Иными словами, это химический источник электрического тока. Подключаем к его электродам электрическую цепь, и по ней начинает течь ток до тех пор, пока не израсходуются все реагенты, участвующие в химической реакции. После этого конструкция восстановлению не подлежит и выбрасывается. Обычно в этом случае мы говорим, что батарейка «села».
В процессе развития гальванический элемент претерпел множество изменений. У Луиджи Гальвани, к примеру, электродами служили медные крючки и стальной скальпель, а электролитом – жидкость мышечных тканей лапки лягушки. В элементах Даниэля-Якоби для электродов использовались цинк и медь, а электролитом служили растворы сульфата меди и сульфата цинка, разделенные ионопроницаемой мембраной. У Василия Петрова электролитом был нашатырь.

Несмотря на такие большие различия, все эти элементы работали на одном и том же принципе – взаимодействии двух металлов в электролите. Сегодня мы не будем копаться в истории и разбирать старые идеи, а поговорим о современных батарейках, праотцом которых считается Жорж Лекланше.
Из чего состоит
Современная батарейка (а это и есть доработанный элемент Лекланше) состоит из цинкового стакана – анода, в котором размещен графитовый стержень – катод. Последний покрыт слоем смеси диоксида марганца с порошкообразным графитом. Остальное пространство стакана заполнено желеобразным электролитом.
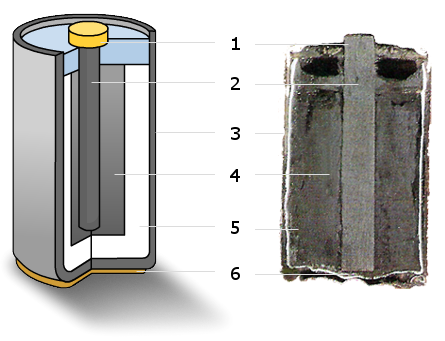
На рисунке цифрами обозначены:
- 1 – металлический колпачок;
- 2 – графитовый стержень;
- 3 – цинковый стакан (анод);
- 4 – смесь диоксида марганца с графитом (катод);
- 5 – электролит;
- 6 – металлическое дно.
Катодом служит диоксид марганца в смеси с графитом (отсюда и название – марганцево-цинковый элемент). Графитовый стержень является лишь токоотводом.
Так выглядят внутренности реальной марганцево-цинковой батарейки
Несколько слов об электролите. В солевых батарейках его роль играет раствор хлорида аммония (NH4Cl), загущенный крахмалом до пастообразного состояния. Именно из-за этого элемент называют сухим – в нем ничего не плещется.
В щелочных (алкалиновых) батарейках, изобретенных Льюисом Урри, в качестве электролита используется щелочь – гидроксид калия (КОН). Что касается конструкции, она та же, только анод представляет собой не цинковый цельный стакан, а порошок.
Упомянем литиевые батарейки (не путать с аккумуляторами!). Во всех них рабочим элементом является литий, входящий в состав анода, отсюда и название. Остальные анодные присадки, материал катода и электролит могут быть разными. От них зависит и электрическая емкость, и, что самое важное, ЭДС, которая колеблется от 1.5 до 3.7 В.
Как работает
Принцип функционирования марганцево-цинкового гальванического элемента сложный. Но если вы дружите с химией, то вкратце для солевой батарейки все выглядит так:

При замыкании внешней цепи электроны по ней с анода (цинк) устремляются на катод (смесь графита с диоксидом марганца):
Здесь электроны расходуются на восстановление H3O+-ионов:
Эти ионы образуются за счет протолиза NH4+-ионов электролита:
При этом выделяется газообразный водород, который создает вокруг графитового катода газовую диэлектрическую прослойку, нарушающую работу элемента. Этот эффект называется поляризацией. Для подавления поляризации используется диоксид марганца, который называют деполяризатором. Благодаря ему H3O+-ионы восстанавливаются с образованием не водорода, а воды:
При этом электролит диссоциирует и частично протолизируется:
Образующиеся на аноде ионы Zn2+ переходят в раствор с образованием нерастворимой соли:
Общая химическая реакция, происходящая при разрядке солевой батарейки, выглядит следующим образом:
В процессе разрядки элемента цинковый электрод, являющийся одновременно стаканом, постепенно разрушается, поэтому его делают (должны делать) с запасом по толщине.
Что касается литиевых батареек, то химических процессов в них такое же множество, как и комбинаций материалов, из которых они изготовлены. Для примера приведем общую химическую реакцию в литиевой батарейке с диоксидом марганца.
Классификация
Как мы уже выяснили, хотя у гальванических элементов сходный принцип работы, они могут иметь в составе самые разные материалы и вещества. Их делят на 3 основных типа:
- солевые;
- щелочные;
- литиевые.
Солевые.
Самый бюджетный тип батареек с посредственными характеристиками. Из особенностей таких элементов можно выделить:
- ЭДС – 1.5 В;
- малые рабочие токи;
- малая электрическая емкость;
- непродолжительный срок службы;
- невысокая стоимость.
Солевые батарейки при длительном хранении в полуразряженном состоянии или при полной разрядке, как правило, «текут», заливая батарейный отсек электролитом.
Щелочные (алкалиновые).
Здесь характеристики намного лучше, но заплатить придется дороже:
- ЭДС – 1.55 В;
- большие рабочие токи;
- хорошая электрическая емкость;
- длительный срок службы;
- не «текут» даже при полной разрядке;
- высокая стоимость.
Литиевые.
Самый, пожалуй, прогрессивный на сегодняшний день тип:
- ЭДС – от 1.5 до 3.7 в зависимости от материалов;
- большая электрическая емкость;
- большие разрядные токи;
- длительный (до 5 лет) срок службы;
- не «текут»;
- есть очень компактные модели;
- высокая стоимость.
Все вышеперечисленные гальванические элементы выпускаются разных типоразмеров. Солевые и щелочные типы, как правило (но не обязательно), имеют цилиндрическую форму. Литиевые кроме цилиндров могут выглядеть как маленькие диски, таблетки, параллелепипеды и пр.
Как составить схему гальванического элемента — задачи по химии
Качественно и полностью рассчитать гальванический элемент с требуемыми параметрами – задача сложная. Но подобрать материал электродов, тип электролита и составить схему сможет любой знакомый с химией. Для примера решим несколько подобных задач.
Задача 1. Вычислить значение ЭДС гальванического элемента с электродами из магния и меди. Электролит – растворы сульфата меди и сульфата цинка. Составить схему элемента, написать химические процессы на электродах и общие процессы, генерирующие энергию.
Решение. По таблице стандартных электродных потенциалов находим потенциалы меди и магния:
Поскольку магний имеет более низкий потенциал, он является анодом. Составляем схему:
Описываем процессы на электродах и общие, генерирующие энергию:
Вычисляем стандартную ЭДС:
Задача решена.
Задача 2. Дано уравнение токообразующей реакции: Ni + СuSO4 = NiSO4 + Cu. Напишите уравнение процессов на электродах, рассчитайте ЭДС.
Решение. При помощи таблицы электродных потенциалов найдем потенциалы никеля меди:
Потенциал никеля ниже, следовательно, он является анодом. Составляем уравнения:
Составляем схему гальванического элемента:
Вычисляем стандартную ЭДС реакции:
Задача решена.
Как сделать ГЭ своими руками
Напоследок практикум. Попробуем самостоятельно собрать гальванический элемент, который можно использовать на практике. Остановимся на схеме Даниэля-Якоби. Его медно-цинковый элемент не только прост в повторении, но и не требует дефицитных компонентов. Тем не менее у этого источника питания неплохие характеристики:
- Ток короткого замыкания – 0.5 А.
- Электрическая емкость – 25-30 А*ч.
- Габариты – стеклянная банка емкостью 0.33 л.
Конструктивно наша батарейка будет иметь следующий вид: стеклянная банка, на дно которой насыпан медный купорос. В банку опущены электроды в виде цилиндров. Анод – алюминий, катод – медь. Между электродами установлена ионопроницаемая диафрагма. Сама банка заполнена двумя электролитами – раствором поваренной соли и раствором медного купороса.

Алгоритм изготовления ГЭ следующий:
- Из тонкого медного листа изготавливается цилиндр по диаметру горлышка банки и высотой чуть ниже нее. На цилиндре необходимо предусмотреть ушки, которыми он будет подвешиваться к горлышку банки. Это катод – положительный вывод элемента.
- Из плотного картона сшивается цилиндр по высоте чуть меньше высоты и диаметра медного цилиндра. К картонному цилиндру пришивается дно, все швы (но не сам стакан) герметизируются парафином. На цилиндр наматывается несколько слоев газетной бумаги, вымоченной в растворе поваренной соли. Для лучшей механической прочности полученную конструкцию можно обшить любой тканью. На верх стакана приклеивается или пришивается картонное кольцо, чтобы он не проваливался в банку. В кольце делается 2 отверстия. Одно для заливки воды в область между банкой и стаканом, второе – для ручки мешалки (о ее назначении – ниже). Перед использованием диафрагму нужно испытать, налив в нее раствор поваренной соли и оставив на несколько часов. Стакан не должен подтекать, а его наружная поверхность должна быть лишь слегка влажной.
- Из тонкой цинковой жести изготавливается цилиндр высотой и диаметром чуть меньше стакана-диафрагмы. Это анод – отрицательный вывод гальванического элемента. На нем, как и на медном, необходимо предусмотреть ушки, за которые он будет подвешиваться на кольцо диафрагмы.
Вместо медного цилиндра можно использовать медный провод без изоляции и лака. Просто обматываете им стакан-диафрагму, предварительно вставив в нее оправку для жесткости, и качественный электрод готов.
Сборка
В банку насыпаем столовую ложку медного купороса, устанавливаем на место медный цилиндр. Опускаем в него мешалку. Устанавливаем внутрь медного цилиндра стакан-диафрагму, наполняем его раствором поваренной соли. В отверстие кольца диафрагмы осторожно наливаем воду. Опускаем в диафрагму цинковый цилиндр, и элемент готов. Осталось поработать мешалкой, чтобы часть купороса растворилась, подключить при помощи зажимов провода – положительный – к медному электроду, отрицательный – к цинковому.
Обслуживание элемента заключается в периодической смене электролита, промывке электродов и добавлении купороса по мере его расходования. Мешалка понадобится, если отдаваемый ток существенно упадет. Слегка взболтали медный купорос на дне, и все снова в порядке.
Электроды должны как можно ближе располагаться друг к другу – это уменьшит внутреннее сопротивление элемента, а значит, и отдаваемый им ток.
Для питания чего-нибудь существенного напряжения не хватит, но что мешает собрать батарею из нескольких таких элементов?
В этой конструкции катод выполнен обычным медным проводом со снятой изоляцией
А теперь пара вопросов.
Первый.
Вы наверняка заметили, что в характеристиках не указана ЭДС элемента. Предлагаем определить этот параметр самостоятельно. Заодно для практики составить его схему. Вы же знаете химические формулы поваренной соли (хлорид натрия) и медного купороса (сульфат меди)?
Второй.
Реально ли заменить цинк алюминием или свинцом и к каким последствиям это приведет?
Вот и все, что хотелось рассказать о гальванических элементах. Теперь вы знаете, какими они бывают, как работают, и даже можете собрать собственный источник энергии для неэлектрифицированной дачи. На приемник, светодиодный фонарь и зарядку мобильника этой энергии хватит на все лето.
Сейчас читают:
























